NIBS 科学家首次利用 CRISPR/Cas9 系统在病人特异性的隐性营养不良性大疱性表皮松解症小鼠模型表皮干细胞中实现成体基因修复
2017 年 1 月 31 日,北京生命科学研究所陈婷实验室在《PNAS》在线发表了题为 “Efficient in vivo gene editing using ribonucleoproteins in skin stem cells of recessive dystrophic epidermolysis bullosa mouse model” 的研究论文。该研究首次利用体外成熟的 Cas9/sgRNA 核糖蛋白复合物在病人特异性的隐性营养不良性大疱性表皮松解症(Recessive dystrophic epidermolysis bullosa, RDEB)小鼠表皮干细胞实现了成体基因修复,从而为 RDEB 疾病以及其它遗传性皮肤疾病的治愈提供了全新方案。
隐性营养不良性大疱性表皮松解症是由皮肤中 VII 型胶原(Collagen VII)蛋白功能异常引起的隐性皮肤遗传病。在正常皮肤中,表皮角化细胞(Keratinocyte)与真皮中的成纤维细胞 (Fibroblast) 分泌的 Collagen VII 首先形成同源三聚体,然后组装成锚原纤维(anchoring fibrils),从而使得表皮与真皮牢固结合。在 RDEB 病人体内,Col7a1 基因中一些突变使得 VII 型胶原功能异常,从而导致表皮与真皮的脱离,产生血疱。基因治疗是唯一可以根治此类疾病的治疗方法。CRISPR/Cas9 系统是一种高效的基因编辑系统,近年来逐渐用来治疗一些以前毫无根治方法的遗传疾病。但,高效的体内导入 CRISPR/Cas9 的转运系统一直制约着这种技术向临床的应用。
为探索利用 CRISPR/Cas9 系统实现成体基因编辑从而治愈 RDEB 疾病,陈婷实验室研究人员首先建立病人特异性地 RDEB 小鼠模型。突变纯合体(Col7a1 c.6485G>A mut/mut)小鼠在出生后出现与病人相似的血疱表型。而杂合型(Col7a1 c.6485G>A wt/mut)小鼠皮肤完整,没有出现任何病症。组织切片结果显示在出现血疱位置的皮肤,表皮与真皮层相分离。即使在没有出现血疱的背部皮肤以及尾巴上的皮肤,表皮与真皮连接松散,也呈现出表皮与真皮分离的表型。Collagen VII 免疫荧光染色结果显示,在野生型老鼠皮肤 Collagen VII 呈线性分布在表皮与真皮之间的基底层位置。而在突变纯合体中,Collagen VII 蛋白则弥散分布在表皮的基底层细胞(Basal cells)以及靠近基底层的真皮层细胞中。
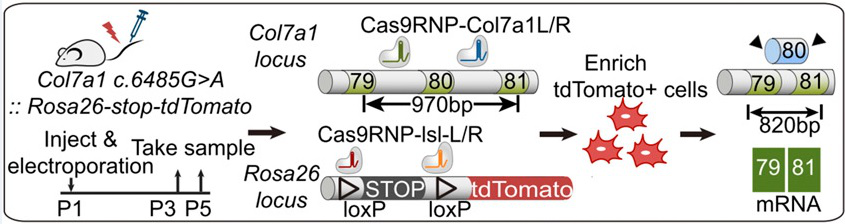
Collagen VII 蛋白按照其结构特征,可分为 N 端 NC1、位于中部的中部螺旋结构域(central helical region)以及 C 端 NC2 结构域。其中中部螺旋结构域在蛋白质一维结构上由许许多多 “Gly-X-Y” 重复序列构成。理论上,将含有突变的第 80 位外显子进行切除后,只会导致 Collagen VII 蛋白在长度上稍微缩短,而不会对其蛋白功能造成影响。为了验证第 80 位外显子切除是否安全,研究人员再一次通过 CRISPR/Cas9 系统介导的 NHEJ 细胞修复途径制作了第 80 位外显子转录缺失小鼠(Col7a1 ΔExon80)。杂合以及纯和突变小鼠与野生型小鼠表型一致,新生鼠与成年鼠都没有 RDEB 疾病的血疱表型。Collagen VII 蛋白无论是在突变杂合体还是纯合体中都呈线性分布在基底层位置。组织切片也显示突变杂合体与纯合体小鼠皮肤组织结构完整,表皮与真皮连接完好。研究人员接下来筛选出能够特异、高效地介导第 80 位外显子切除的 sgRNAs,并在体外表皮干细胞系中验证了 sgRNA 能够成功介导第 80 位外显子切除。
随后,研究人员建立了通过电击介导的 Cas9/sgRNA 核糖蛋白复合物皮内导入系统。为了准确、严谨地证明 CRISPR/Cas9 系统转运到皮肤细胞内并且能够正常发挥其功能,研究人员用表达 Cas9 蛋白以及两个特异性识别 Flox 位点的 sgRNA 的质粒通过电击的方法导入皮肤细胞来激活 Rosa26-stop-tdTomato 小鼠尾部皮肤细胞,发现几乎所有的 RFP + 细胞分布在已分化的角质细胞中。当将质粒替换成 Cas9/sgRNA Ai14-L/R 核糖蛋白复合物时, Cas9/sgRNA 核糖蛋白复合物不但能够转运到已分化的角质细胞中,同样可以高效的转运到基底层细胞中。通过长时间的跟踪观察。研究人员证实 RFP + 基底层细胞不但可以随着时间进行扩增,而且可以分化成表皮层细胞。
为了证明 Cas9/sgRNA 核糖蛋白复合物在小鼠体内对 Col7a1 基因进行了外显子切除,并且合成了 80 位外显子缺失的 mRNA,研究人员在 Col7a1 c.6485G>A mut/mut, Rosa26-stop-tdTomato fl/wt 小鼠中,利用 Cas9/sgRNA(sgRNA col7a1-L/R, sgRNA-Ai14-L/R)核糖蛋白复合物进行 Col7a1 第 80 位外显子切除同时激活 Ai14 细胞。在富集 RFP + 细胞中,研究人员在小鼠体内成功检测到了基因组 DNA 以及 mRNA 编辑之后的产物,并且通过测序进行了验证。更为重要的是,研究人员对修复后的小鼠皮肤中 Collagen VII 进行了免疫荧光染色的分析。一旦进行一次皮内注射 Cas9/sgRNA-col7a1-L/R 核糖蛋白复合物并进行电击后,Collagen VII 蛋白在基底层处分布明显增多。另外,在经过基因修复后的 col7a1 c.6485G>A-mut/mut 小鼠中,表皮与真皮粘附比例从~ 30% 上升到~ 60%。
综上所述,Cas9/sgRNA 核糖蛋白复合物能够通过电击介导体内 Col7a1 基因的编辑,从而,恢复 Collagen VII 蛋白功能,并且,修复 RDEB 表型。
北京大学 - 清华大学 - 北京生命科学研究所(PTN)联合培养项目吴文波为本文第一作者;其他作者包括陈婷实验室博士生陆智伟、李飞、钱南南、技术员王文洁、张昱实验室博士生段金志;该论文的其他作者还包括我所张昱博士,转基因中心的王凤超博士;陈婷博士为本文通讯作者。该研究由北京市科学技术委员会、科技部 973 项目资助,在北京生命科学研究所完成。
论文原文:Efficient in vivo gene editing using ribonucleoproteins in skin stem cells of recessive dystrophic epidermolysis bullosa mouse model
来源:nibs



